Білки – складні біополімери. Будова і властивості білків.
Пригадайте
Що таке макромолекули, мономери і полімери?
Яка роль білків у житті організмів?
Що таке гемоглобін і ферменти?
Серед різних органічних сполук у живих організмів білкам належить провідна роль.
Ці сполуки переважають у клітинах і кількісно. Так, у клітинах тварин вони становлять до 40-50% сухої речовини, а рослин - до 20-35%. До складу молекул білків входять атоми Карбону, Оксигену, Нітрогену, Гідрогену, Сульфуру, а також Фосфору, Феруму та ін.
Що собою становлять білки?
Білки - це висо-комолекулярні біополімери, мономерами яких є залишки амінокислот (мал.8). Нескінченна різноманітність білкових молекул забезпечується різними комбінаціями залишків лише 20 амінокислот (кількість можливих варіантів у цьому випадку становить приблизно 2 • 1018). Кожен білок характеризується постійним складом амінокислотних залишків та їхньою певною послідовністю.
Усі амінокислоти мають спільну групу атомів. Вона складається з аміногрупи (-NH2), якій притаманні лужні властивості, та карбоксильної групи (—СООН) з кислотними властивостями. Ці групи, як і атом Гідрогену, зв'язані з одним і тим самим атомом Карбону. Групи атомів, за якими амінокислоти розрізняються між собою, називають радикалами, або R-групами.
Двадцять амінокислот, залишки яких входять до складу білків, називають основними.
Існують різні класифікації амінокислот. Зокрема, їх поділяють на замінні та незамінні. Замінні амінокислоти можуть синтезуватись в організмі людини і тварин з продуктів обміну речовин. Натомість незамінні амінокислоти в організмі людини і тварин не синтезуються. Вони надходять разом з їжею. їх синтезують рослини, гриби, бактерії.
Білки, які містять усі незамінні амінокислоти, називають повноцінними, на відміну від неповноцінних, до складу яких не входять ті чи інші незамінні амінокислоти. У таблиці наведено повні та скорочені назви амінокислот.
Яка будова білків?
Амінокислотні залишки у молекулі білка сполучаються між собою міцним ковалентним зв'язком, який виникає між карбоксильною групою однієї амінокислоти і аміногрупою іншої.
NH2—CH—COOH
|
R
Загальна формула амінокислоти
Назви основних амінокислот та їхні скорочені позначення
Такий тип зв'язку називають пептидним (від грец. пептос — зварений). Структури, які складаються з великої кількості амінокислотних залишків, належать до поліпептидів:
...NH2—CH—CO—NH—CH—CO—NH—CH—COOH...
I I I
R1 R2 R3
I I I
R1 R2 R3
Поліпептиди з високою молекулярною масою (понад 6000) називають білками. Вони складаються з одного або кількох поліпептидних ланцюгів, які можуть містити до кількох тисяч амінокислотних залишків.
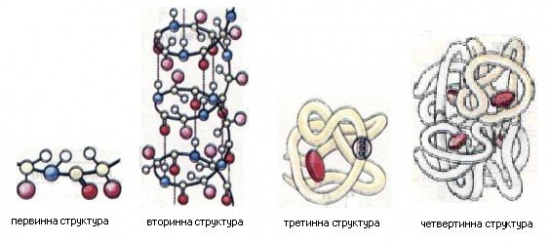
Відомо чотири рівні структурної організації білків: первинний, вторинний, третинний і четвертинний (мал.9).
Первинна структура білків визначається якісним і кількісним складом амінокислотних залишків, а також їхньою послідовністю.
Первинна структура білків визначається якісним і кількісним складом амінокислотних залишків, а також їхньою послідовністю.
Часто молекула білка у вигляді ланцюга, складеного з амінокислотних залишків, нездатна виконувати специфічні функції. Для цього вона має набути складнішої просторової структури.
O H
|| |
—C—N—
Схема пептидного зв 'язку
Вторинна структура характеризує просторову організацію білкової молекули, яка повністю або частково закручується в спіраль. Радикали амінокислот (R-групи) при цьому залишаються ззовні спіралі. У підтриманні вторинної структури важлива роль належить водневим зв'язкам, які виникають між атомами Гідрогену NH2-rpynn одного витка спіралі та Оксигену СО-групи іншого.
Вторинна структура характеризує просторову організацію білкової молекули, яка повністю або частково закручується в спіраль. Радикали амінокислот (R-групи) при цьому залишаються ззовні спіралі. У підтриманні вторинної структури важлива роль належить водневим зв'язкам, які виникають між атомами Гідрогену NH2-rpynn одного витка спіралі та Оксигену СО-групи іншого.
Мал. 9. Просторові моделі структурної організації білків
Третинна структура зумовлена здатністю поліпептидної спіралі закручуватись певним чином у грудку, або глобулу (від лат. глобулюс - кулька). На малюнку 9 наведено схематичну структуру білка міоглобіну. Важлива роль у підтриманні третинної структури належить так званим дисульфідним зв'язкам, які виникають між залишками амінокислоти цистеїну.
Четвертинна структура білків виникає внаслідок об'єднання окремих глобул, які разом утворюють функціональну одиницю. На малюнку 9 схематично зображено четвертинну структуру гемоглобіну, молекула якого складається з чотирьох фрагментів білка міоглобіну. Стабілізація четвертинної структури досягається гідрофобними, електростатичними та іншими взаємодіями, а також водневими зв'язками.
Залежно від конфігурації білки можуть бути фібрилярними та глобулярними. Молекули фібрилярних білків складаються з видовжених, паралельно розташованих поліпептидних ланцюгів. Як правило, ці білки нерозчинні у воді й виконують в організмі структурну функцію (наприклад, кератин входить до складу волосся людини або шерсті тварин). Молекули глобулярних білків складаються зі щільно скручених поліпептидних ланцюгів і за формою нагадують кульку. Ці білки здебільшого розчинні у воді та сольових розчинах. Вони виконують в організмі різноманітні функції (наприклад, гемоглобін забезпечує транспорт газів, пепсин - розщеплення білків їжі).
Залежно від особливостей будови білки поділяють на прості та складні. Прості, або протеїни (від грец. протос — перший), складаються лише з амінокислотних залишків, а складні, або протеїди (від грец. протос та ейдос - вигляд), у своєму складі мають також залишки фосфатної та нуклеїнових кислот, вуглеводів,ліпідів, атоми Феруму, Цинку, Купруму та ін.
Які властивості білків?
функціональні властивості білків, крім їхнього амінокислотного складу, зумовлені також і послідовністю амінокислотних залишків у поліпептидному ланцюзі та його просторовою структурою.
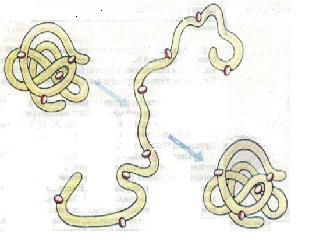
Одна з основних властивостей білків — це їхня здатність під впливом різних факторів (дія концентрованих кислот і лугів, важких металів, високої температури тощо) змінювати свою структуру і властивості. Процес порушення природної структури білків, який супроводжується розгортанням поліпеп-тидного ланцюга без зміни його первинної структури, називають денатурацією (від лат. де - префікс, який означає втрату, і натура - природні властивості) (мал. 10). Як правило, денатурація має необоротний характер. Проте на початкових стадіях денатурації за умови припинення дії факторів, що спричиняють цей процес, білок може відновити свій початковий стан. Це явище має назву ренатурації (від лат. ре -префікс, який означає поновлення). У живих організмів відбувається часткова оборотна денатурація білків, пов'язана з виконанням ними певних функцій - забезпеченням рухової активності, передачею в клітини сигналів з довкілля, прискорення біохімічних реакцій тощо.
Процес порушення первинної структури білків називають деструкцією (від лат. деструкціо - руйнування). Він завжди має необоротний характер.
Залежно від розчинності або нерозчинності у воді білки поділяють на гідрофільні та гідрофобні. Серед білків є активні у хімічному відношенні (наприклад, ферменти) і малоактивні. Деякі білки стійкі до дії різних факторів (наприклад, температури, хімічних чинників), інші - нестійкі. Наприклад, кератин, який входить до складу волосся, кігтів, нігтів, копит, здатний витримувати високу й низьку температуру. Натомість білок яйця птахів (овальбумін) при нагріванні змінює свою структуру.
1. Що таке білки?
2. Яка будова білків?
3. Яка будова амінокислот?
4. Що таке замінні та незамінні амінокислоти?
5. Як амінокислоти сполучаються в поліпептидний ланцюг?
6. Які ви знаєте рівні структурної організації білків?
5. Які властивості притаманні білкам?
Поміркуйте
2. Яка будова білків?
3. Яка будова амінокислот?
4. Що таке замінні та незамінні амінокислоти?
5. Як амінокислоти сполучаються в поліпептидний ланцюг?
6. Які ви знаєте рівні структурної організації білків?
5. Які властивості притаманні білкам?
Поміркуйте
Що спільного та відмінного в процесах денатурації та деструкції?
Чим зумовлена різноманітність властивостей білків?
Яку роль у житті організмів відіграє здатність молекул білка до денатурації?
Чому відсутність у харчовому раціоні людини білків тваринного походження негативно впливає на життєдіяльність її організму?
Чим зумовлена різноманітність властивостей білків?
Яку роль у житті організмів відіграє здатність молекул білка до денатурації?
Чому відсутність у харчовому раціоні людини білків тваринного походження негативно впливає на життєдіяльність її організму?
М.Є. Кучеренко, Ю.Г. Первес, П.Г. Балан, В.М. Войціцький, Загальна біологія, 10 клас
Функції білків. Ферменти.
Пригадайте
Що таке органели?
Що таке ендосперм, антитіла та антигени?
Що таке катіони та аніони?
Одна з основних функцій білків - будівельна, або структурна. Білки є складовою частиною біологічних мембран. З них складаються структури, які виконують роль скелета клітин.
Як ви пам'ятаєте, головним компонентом хрящів і сухожилків є пружний міцний білок колаген (мал. 11). Волокна, що складаються з цього білка, є у багатьох різновидах сполучної тканини і надають їм міцності. Пружності кісткам надає білок осеїн.

Мал.11. Схема колагенових волокон
Захисна функція білків полягає у запобіганні пошкодженням клітин, органів, проникненню в організм сторонніх сполук, хвороботворних мікроорганізмів, інших чужорідних тіл. Наприклад, особливі захисні білки - імуноглобуліни, або антитіла, що утворюються в організмі хребетних тварин і людини, здатні «впізнавати» та знешкоджувати бактерії, віруси, чужорідні для організму білки. Білки крові - фібрин, тромбопластин і тромбін - беруть участь у процесах її зсідання, що запобігає великим крововтратам у разі ушкодження стінок кровоносних судин.
Окремі складні білки клітинних мембран, змінюючи свою структуру, передають сигнали із зовнішнього середовища на інші ділянки мембрани або всередину клітини. Так вони здійснюють сигнальну функцію.
Завдяки скоротливій (або руховій) функції білків клітини, тканини, органи або увесь організм можуть змінювати форму, рухатись. Скоротливі білки актин і міозин, які входять до складу м'язових та деяких інших клітин, забезпечують їхню здатність до скорочення (мал.12). Білок тубулін входить до складу мікротрубочок - компонентів джгутиків і війок певних клітин еукаріотів.
Деякі білки можуть відкладатись у клітинах про запас, тобто виконують запасаючу функцію (мал.13). Наприклад, білок овальбумін, що накопичується у білковій оболонці пташиних яєць. Його споживає пташеня перед виходом з яйця. В ендоспермі насіння багатьох видів рослин (пшениці, кукурудзи, рису та ін.) відкладаються білки, які споживають зародки під час свого розвитку. Це живильна функція білків.
Мал. 13. Білкові включення у зернівці пшениці
Одна з основних функцій білків - транспортна. Гемоглобін - дихальний пігмент крові людини, хребетних і багатьох безхребетних тварин - переносить кисень і деяку частку (до 10%) вуглекислого газу (мал.14). Цим забезпечується газообмін у клітинах і тканинах.
Мал. 14. Молекула гемоглобіну
Енергетична функція білків полягає в тому, що за повного розщеплення 1 г білків у середньому звільняється 17,2 кДж енергії.
Деякі білки (гормони білкової природи, ферменти) виконують регуляторну функцію. Вони регулюють активність обміну речовин, процеси росту і розвитку організмів.
Важливою функцією білків є каталітична. Каталіз (від грец. каталіз - припинення) - зміна швидкості перебігу хімічних реакцій під дією певних хімічних сполук. Каталітичну функцію - біокаталіз -у живих організмах виконують ферменти.
Що таке ферменти? Які їхні функції?
Ферменти (від лат. ферментум - закваска), яких відомо понад 6 000, - це прості (однокомпонентні) або складні (двокомпонентні) білки. Складні білки, на відміну від простих, містять ще й небілкову частину у вигляді певних органічних сполук (наприклад, похідних вітамінів), катіонів або аніонів.
Білкова частина молекули ферменту визначає його специфічність щодо речовин, реакцію за участю яких цей фермент каталізує. Але активність складних ферментів виявляється лише тоді, коли його білкова частина сполучається з небілковою. Каталітичну активність ферменту зумовлює не вся його молекула, а лише її невелика ділянка - так званий активний центр. Його структура відповідає хімічній будові речовин, які вступають у реакцію. В одній молекулі ферменту може бути кілька активних центрів.
Ферменти прискорюють перебіг біохімічних процесів у 100 -1 000 разів порівняно з тими, які відбуваються у середовищі без ферментів. Завдяки ферментам енергія, необхідна для перебігу реакції, менша, ніж без їхньої участі (мал. 15).
Мал. 15. Схема дії ферменту
Активність ферментів виявляється лише за відповідних умов: певної температури, тиску, кислотності середовища тощо. Ферментативні реакції відбуваються у кілька послідовних етапів. Ланцюги взаємопов'язаних ферментативних реакцій забезпечують нормальний перебіг процесів обміну речовин і перетворення енергії в організмі.
Ферменти (зокрема їхні активні центри) утворюють нестійкий комплекс з речовинами, які вступають у реакцію. Цей комплекс згодом швидко розпадається з утворенням продуктів реакції. Сам фермент при цьому свою структуру, а відповідно і активність, не втрачає і здатний каталізувати наступну подібну реакцію.
У клітині багато ферментів пов'язано з плазматичною мембраною або мембранами окремих органел (мітохондрій, пластид тощо). Деякі ферменти беруть участь у транспортуванні речовин через мембрани.
Контрольні запитання
Контрольні запитання
1. Які основні біологічні функції білків?
2. У чому полягає захисна функція білків?
3. Чим визначається рухова функція білків?
4. Що собою становлять ферменти?
5. Які функції виконують ферменти?
6. Завдяки чому ферменти здатні виконувати свої функції?
7. Завдяки яким властивостям білків живі організми здатні сприймати подразники?
Поміркуйте
2. У чому полягає захисна функція білків?
3. Чим визначається рухова функція білків?
4. Що собою становлять ферменти?
5. Які функції виконують ферменти?
6. Завдяки чому ферменти здатні виконувати свої функції?
7. Завдяки яким властивостям білків живі організми здатні сприймати подразники?
Поміркуйте
Чому без участі ферментів перебіг більшості біохімічних процесів у клітині був би неможливим?
У результаті ферментативних реакцій, на відміну від безфер-ментних, не утворюються побічні продукти, тобто спостерігається майже 100 %-й вихід кінцевого продукту. Яке це має значення для нормального функціонування організму?
У результаті ферментативних реакцій, на відміну від безфер-ментних, не утворюються побічні продукти, тобто спостерігається майже 100 %-й вихід кінцевого продукту. Яке це має значення для нормального функціонування організму?
М.Є. Кучеренко, Ю.Г. Первес, П.Г. Балан, В.М. Войціцький, Загальна біологія, 10 клас




Немає коментарів:
Дописати коментар